
Lektor, Søren Werner Karlskov Hansen
Cancer- og Inflammationsforskning
CV, publikationer
Telf. 6550 3062
Email: shansen@health.sdu.dk
Information til nye studerende
Forskning
Medfødt immunitet, mønster genkendelse molekyler og komplementsystemet
Grunden til at vi er sunde det meste af tiden, skyldes en del af vores immunsystem benævnt det medfødte immunsystem. Det forsvarer os mod mikroorganismer uden vi bemærker det, og ofte uden at der er tegn på egentlig sygdom. Når nogle mikroorganismer alligevel udvikler sig til patogener, der koloniserer vores krop, skyldes det, at de undslipper opmærksomheden eller virkningen af det medfødte immunsystem. I de situationer beror vores immunforsvar på tillærte mekanismer med udvikling af patogen specifikke B og T celler; ofte med alvorlige betændelsestilstande (inflammation), feber og længerevarende sygdom til følge. En særlig vigtig del af det medfødte immunsystem er komplementsystemet, som findes i blodet i form af inaktive proteiner, der aktiverer efter genkendelse af mikroorganismer. Komplementaktivering fører til kovalent mærkning af den mikrobielle overflade med komplementprodukter. Mærkningen leder efterfølgende til forøget fagocytose, tiltrækning af granulocytter og endda direkte lysering (drab) af mikroorganismerne. Tre særskilte aktiveringsveje kan aktivere komplementsystemet: den klassiske, alternative og lektin ”pathway”. Vi var involveret i opdagelsen af lektin aktiveringsvejen, der beror på genkendelse af fremmede (ikke-selv) mikrobielle glycokonjugater (Fig. 1). For nylig var vi pionerer i opdagelsen af nye mønstergenkendelsesmolekyler, der i kompleks med hinanden aktiverer komplementsystemet effektivt via lektinaktiveringsvejen. Disse molekyler omfatter kollektinerne: Collectin Kidney 1 (CL-K1) og Collectin liver 1 (CL-L1) og deres fælles heteromere kompleks, benævnt CL-LK (Fig. 1).
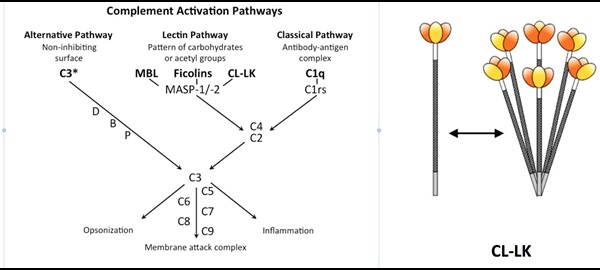
Vores forskellige CL-LK-relaterede projekter undersøger betydningen af CL-LK (CL-K1 og CL-L1) i udviklingen og patogenesen af infektioner, autoimmune sygdomme og tromboser (interaktion med koagulationssystemet). Vores hypotese er, at CL-LK- medieret komplementaktivering er en afgørende faktor i disse sygdomme. Lave CL-LK niveauer og mangel på komplementaktivering kan være forbundet med infektioner, mens høje niveauer og ekspression af ændret selv-glycokonjugater kan være forbundet med udviklingen af komplement-medierede autoimmune sygdomme og tromboses.
Terapeutiske antistoffer: uønskede immunreaktioner og individualiseret behandling
Behandling med terapeutiske antistoffer bliver oftere og oftere anvendt til behandling af et ekspanderende antal inflammatoriske sygdomme, herunder Crohns sygdom, ulcerativ colitis, rheumatoid arthritis, ankyloserende spondylitis, psoriasis og psoriasis arthritis.
Imidlertid bliver behandlingen ofte hæmmet af udvikling og tilstedeværelsen af såkaldte ”anti-drug” antistoffer, der er afledt fra patientens eget immunforsvar. Sådanne anti-drug antistoffer kan føre til anafylaktiske reaktioner og / eller ineffektiv behandling. For at identificere og karakterisere ikke-responderende patienter, har vi udviklet assays til kvantificering af patientens egne anti-drug antistoffer, med fokus på antistoffer, som neutraliserer de indgivne terapeutiske antistoffer. Vi har taget vores udgangspunkt i terapeutiske anti-TNFα -antistof (Infliximab / Remicade / Remsima) (Fig. 2), men setup’et er anvendeligt for andre terapeutiske antistoffer. Vi undersøger p.t. fordelene ved vores assays i en kohorte af patienter med inflammatoriske tarmsygdomme. Pålidelig vurdering af individuel immunogenicitet og halveringstid i patienterne kan lede til optimering af dosis og samtidig forhindre langvarig brug af utilstrækkelig terapi. Perspektivet er at økonomisere sundhedssystemets brug af terapeutiske antistoffer, der i stigende grad er en byrde.

Ikke-invasive markører for progression og sværhedsgrad af hæmatologiske sygdomme
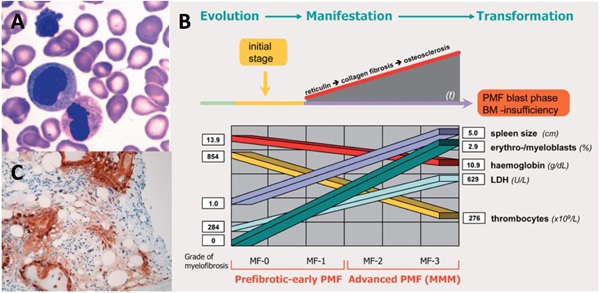
Den hæmatologiske sygdom, primær myelofibrose (PMF) er en kronisk myeloproliferativ neoplasme, der er karakteriseret ved bl.a. knoglemarvsfibrose, splenomegali og anæmi. Ved myeloproliferative neoplasmer generelt, men især ved PMF, er den ellers nøje reguleret balance mellem knoglemarv matrix syntese og nedbrydning ændret. Derfor observeres neo-angiogenese, stromal spredning med udbredt knoglemarvsfibrose til følge og nedsat og/eller ændret funktion af knoglemarvens dannelse af nye blodceller.
Strategien for behandling af myelofibrose varierer betydeligt afhængigt af fænotype, sværhedsgrad og progression af sygdommen, og kræver derfor specialiserede immunhistokemiske undersøgelser af patientens knoglemarv. Vi har fundet, at prokollagen type I (PINP), der syntetiseres og udskilles fra fibroblaster og osteoblaster, kan være en potentiel biomarkør for PMF sværhedsgrad og progression (Fig. 3). Vi karakteriserer p.t. sammenhænget mellem PINP niveauer i blodet og
sygdoms-sværhedsgrad i en kohorte af patienter med myeloproliferative neoplasmer. Nemmere, bedre og hurtigere bestemmelse af PMF sygdoms-progression og -sværhedsgrad leder til bedre behandling af PMF.
Citationer og publikationsstatistik
Google Scholar (up to date H-index and more)
Orchid ID: 0000-0002-8186-4630
ResearchGate
Information til nye studenter
I 2016/2017 søger vi nye og motiverede studerende til følgende forskningsprojekter:
“Medfødt immunitet, mønster genkendelsesmolekyler og komplementsystemet” og ”Terapeutiske antistoffer: uønskede immunreaktioner og individualiseret behandling”. Kontakt Søren W. K. Hansen pr. mail eller ved personligt fremmøde på kontor / laboratorium. J.B. Winsløws Vej 21, 1. sal.
Anerkendelse og tak
Uden bevillinger fra private fonde og statslige organisationer kunne vi ikke forske. Blandt mange danske fonde, der yder støtte til sygdomsbekæmpende forskning, vil vi gerne takke:
A. P Møller Fonden
Augustinusfonden
Dagmar Marshalls Fond
Familien Hede Nielsens Fond
Frimodt-Heineke Fonden
Højbjerg fonden